
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
IX CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XVI - 2000 - pág 67 a 71.
RESUMEN
El cultivo in vitro de ananá (Ananas comosus (L.)Merr) fue evaluado como una fuente continua y estandarizada para la obtención de "bromelina", un conjunto de enzimas proteolíticas de la planta. Se realizó una extracción con acetona fría (-20° C) de los callos obtenidos a partir de las yemas axilares. Se obtuvo un polvo acetónico con apreciable actividad caseinolítica. Se determinó el pH óptimo, el rango de temperatura óptima, estabilidad térmica, y contenido proteico de la preparación enzimática. Se lo trató con distintos inhibidores específicos, encontrándose que pertenece al grupo de las cisteinil proteinasas.
Cell culture of anana [Ananas comosus (L.) Merr]was evaluated as a continued and standardized source for the obtention of bromelain, a complex of proteolitic enzymes frorn the pineapple plant. The calli obtained from axilary buds were extracted with cold acetone (-20°C). The acetone powder had caseinolitic activity. The optimum pH, the optimum temperature range, the thermal stability and the protein contení of enzimatic preparation were determinated. The treatment with different inhibitors showed that it belongs to the cysteine proteinase group.
INTRODUCCIÓN
El jugo de ananá ha sido usado largo tiempo como medicina folklórica por los nativos de trópicos como ayuda digestiva y en forma externa para trastornos de epidermis. En la actualidad, la bromelina - un complejo estandarizado de las proteinasas de la planta de ananaes usada ampliamente en la industria farmacéutica - se utiliza en los casos de inflamación asociado con edema (por ejemplo, edema post-operatorio); en inflamaciones del tracto respiratorio; en inflamaciones causadas por trastornos circulatorios (tromboflebitis y várices) y para mejorar la actividad de los antibióticos.(6)
Además, estudios in vitro e in vivo con animales de laboratorio demostraron que los tumores inducidos pueden ser inhibidos por acción de la bromelina.(6,7)
En la actualidad, hay grupos de investigación que han obtenido plantas de ananá por cultivo in vitro y otros grupos que han caracterizado y purificado las proteasas a partir de plantas enteras. (4,9)
En investigaciones previas de otros autores, se obtuvieron proteasas a partir del cultivo in vitro, (1) pero éstas no fueron caracterizadas.
OBJETIVO
Nuestro objetivo es determinar la presencia de enzimas proteolíticas del mismo tipo del que se encuentran en la plantas. El cultivo in vitro es una alternativa interesante para la obtención permanente de material homogéneo y permitir la optimización de la producción de los compuestos buscados.
MATERIALES Y MÉTODOS
Material vegetal: Se partió de yemas axilares de ananá que fueron desinfectadas primero durante 20 segundos con alcohol 70°, y luego con hiplocorito de sodio comercial al 12% y gotas de Tween 20, durante 10 minutos con agitación permanente.
Medio de Cultivo: Solución salina completa y vitaminas de Murashige Skoog (8) con concentración de cobre reducida a la mitad del medio original, sacarosa 30 g/1, agar 7 g/1, ácido naftalén acético (ANA) y diferentes concentraciones de bencil adenina (BA). Medio 1 (MI) 10 ppm de ANA y Ippm de BA; Medio 2 (M2) 10 ppm de ANA y 0,5 ppm de BA.
Condiciones de Cultivo: Temperatura de 24° * 1 °C. Fotoperíodo de 16 hs. de luz a 800 lux. Realización de subcultivos cada 30 días.
Análisis de Crecimiento: Sobre la base del peso húmedo inicial y final de los callos obtenidos se realizó el test de t de índice de crecimiento.
Extracción y Determinación de Proteinasas: Se preparó un polvo cetónico de los callos con acetona a -20° C en relación 25 % (w/v). Se realizó una extracción con buffer fosfato 0,1 M, pH 6,0 , EDTA 5 mM, 2-mercapto etanol 10 mM. Se centrifugó 30 minutos a 10000 g a 4° C. El sobrenadante obtenido se utilizó para realizar las diferentes determinaciones. Esta preparación enzimática contiene 3 g de polvo acetónico por cada 100 mi de solución.
Actividad Proteolítica: Se utilizó el método de Kunitz (5). La mezcla de incubación consiste en 0,5 mi del preparado enzimático, 0,5 mi de buffer fosfato, 0,1 M EDTA 5 mM, y 1 mi de solución de caseína al 1 % en el buffer fosfato conteniendo 1 mM de 2-mercapto etanol. Al cabo de 20 minutos se detuvo la reacción mediante el agregado de 3 mi de ácido tricloroacético al 5%. La mezcla se filtra y se lee la absorbancia a 280 nm. La actividad proteolítica se expresa en unidades. Una unidad es la cantidad de enzima que produce un cambio de 0,001 de absorbancia por minuto a 280 nm bajo las condiciones de ensayo (20 minutos a 37° C). La concentración de proteínas se determina por el método de Bradford.(2); la elección de esta técnica se debe a que la presencia de EDTA y fenoles no interfieren en la reacción.
Variación de la Actividad Proteolítica en función del pH y la Temperatura: Para determinar la variación de la actividad en función del pH y la temperatura se utilizan soluciones de caseína en las condiciones anteriormente indicadas, preparadas en buffer cítrico citrato pH 5,5; buffer fosfato pH 5,8 a 7; buffer tris pH 7 a 9; buffer carbonato bicarbonato pH 9a 10; todos en concentración 0,1 M y conteniendo 5 mM de EDTA. El comportamiento enzimático a distintas temperaturas se determina a pH 7,0 en el rango de 25 a 70° C.
Estabilidad Térmica de las Soluciones Enzimáticas: Se incubaron las preparaciones enzimáticas a diferentes temperaturas entre 40 y 70° C durante 20, 30 y 60 minutos.
Al término de los tiempos indicados, las muestras se colocan en baño de hielo hasta que se ensayan la actividad caseinolítica como se describió anteriormente.
Ensayos de inhibición: La preparación enzimática (0,5 mi) fue incubada con varios inhibidores (10 ul) por 30 minutos a 30° C. El control no contiene inhibidor y fue tratado de la misma manera. Subsecuentemente, las muestras fueron tratadas como se indicó para los ensayos standard.
Contenidos de Hidratos de Carbono: Se determinó por el método de Dubois (3).
RESULTADOS Y DISCUSIÓN
Para la obtención de las plántulas in vitro, se utilizó un medio de cultivo previamente estudiado y seleccionado en trabajos anteriores de nuestro laboratorio, donde las plántulas se desarrollaron más rápido y exitosamente. Dichas plántulas, obtenidas a partir de las yemas axilares de la corona del ananá, fueron utilizadas para la iniciación de los callos.
De los 2 medios ensayados para la obtención de callos, el medio 2 fue el que produjo callos más friables y el que mostró mayor índice de crecimiento: M1 0,854g + 0,22g y M2 1,9g + 0,54g, resultando la diferencia significativa para p< 0,001. El contenido de hidratos de carbono en el extracto obtenido a partir de los callos fue de 1,28 mg/ml. Los preparados enzimáticos de los callos muestran una actividad caseinolítica de 400 unidades por gramo de polvo acetónico con una actividad específica de 46,2 U/mg de proteína en las condiciones de ensayo.
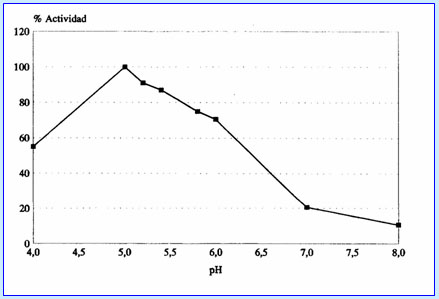
En la Figura 1 se muestra la variación de la actividad caseinolítica a diferentes valores de pH; ésta es máxima a pH=7 y muestra poca variación entre los valores de pH 6 a 8, disminuyendo al 48% a pH = 10.
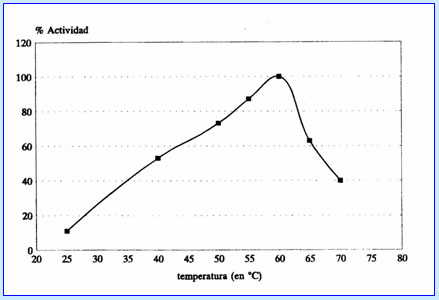
En la Figura 2 se puede observar el comportamiento del preparado enzimático a diferentes temperaturas. Se ve un máximo de actividad a los 60° C; a temperatura ambiente solo muestra una leve actividad (11% del valor máximo). Más allá de los 65° C se nota un rápido decaimiento de la actividad.
La preparación enzimática mostró una estabilidad elevada a temperaturas moderadas; a 50° C hasta los 60 minutos conserva un 76 % de la actividad inicial. A temperaturas más elevadas (70° C) la actividad se reduce rápidamente siendo totalmente inactivada a los 60 minutos (Tabla 1). Para identificar los grupos catalíticos en el centro activo de las proteasas, se utilizaron inhibidores específicos (10): el fenil metil sulfonil floruro, la o-fenantrolina, la pepstatina A y el E-64.
Los datos muestran que la actividad enzimática en los callos se inhibió por el E-64, un inhibidor específico de cisteinil proteinasas (Tabla 2). De acuerdo con estos datos, la preparación enzimática mostraría que pertenece al mismo tipo de enzimas (cisteinil proteinasas) que la obtenida a partir de planta entera.
CONCLUSIONES
De acuerdo con los resultados logrados, el método de cultivo in vitro se muestra como una opción eficaz para la obtención de bromelina. De esta forma, se tendría oportunidad de obtener en forma accesible y continua esta preparación enzimática, evitando las fluctuaciones debidas a disponibilidad y variabilidad de la materia prima. Estudios posteriores permitirán una optimización en la producción de estas enzimas.
20 |
98 % |
70 % |
28 % |
30 |
88 % |
64 % |
9,6 % |
60 |
76 % |
43 % |
0 |
El preparado enzimático se mantiene durante distintos lapsos de tiempo a diferentes temperaturas y luego se determina la actividad caseinolítica residual.
Ninguno |
- |
100 |
PMSF |
100 mM |
82 |
Pepstatina A |
100 ug/ml |
88 |
O-fenantrolina |
100 mM |
98 |
E-64 |
10 mM |
12 |
|
|
|