
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
IX CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XVI - 2000 - pág 27 a 34.
RESUMEN
Las partes aéreas de Xanthium cavanillesii dieron 24-metilencicloartanol, lupeol, (ß-amirina, stigmasterol, campesterol, sitosterol, loliode y varios xanthanolidos. Los extractos hexánico y cloroformico de esta planta mostraron un moderado efecto inibitorio sobre la germinación de Lactuca sativa. Se reportan por primera vez los datos de 1H-RMN para 24-metilencicloartanol.
Aerial parts of Xanthium cavanillesii afforded 24 methylenecycloartanol, lupeol, (β-amyrin, stigmastarol, campesterol, sitosterol, loliolide and several xanthanolides. The hexane and chloroform extracted of this plant showed a moderate inhibitory effect on the germination of Lactuca sativa. 1H-NMR and MS data of 24-methylenecycloartanol are reported for the first time.
INTRODUCCIÓN
La especie sudamericana Xanthium cavanillesii Schouw, conocida vulgarmente con el nombre de "abrojo", "abrojo grande" ó "abrojo macho" es una maleza invasora común en la región pampeana y el centro y norte de nuestro país. Es frecuente en potreros, baldíos, campos cultivados y orillas de acequias1-3. Los frutos conservan el poder germinativo por varios años y son diseminados por los animales a cuyo pelo o lana se adhieren con facilidad por medio de las espinas ganchudas del involucro3. Fue declarada "Plaga de la Agricultura" por decreto nacional del 13-X-1914.La infusión de hojas de X. cavanillesii es usada en medicina tradicional por sus propiedades purgantes y antiespasmódicas; se usa también para el lavaje de úlceras y heridas cutáneas. Las semillas y raíces son diuréticas y antidisentéricas2. Los cotiledones y plántulas recién germinadas resultan tóxicas para porcinos, ovinos y bovinos. Los animales comen voluntariamente y mueren al cabo de 12 a 24 hs. de haberlos ingerido. La necropsia indica congestión hepática con zonas de necrobiosis y necrosis, inflamación del tubo digestivo, preferentemente duodeno, y nefrosis tóxica. La toxicidad es atribuida a la presencia de saponinas y quizás a algún glicósido derivado de una hidroquinona del tipo reportado en semillas cotiledones y plantas jóvenes de otras especies del mismo género3.
OBJETIVOS
Recientemente hemos reportado6 la presencia de varias lactonas sesquiterpenicas tipo xanthanolido en el extracto cloroformico de X. cavanillesii. En el presente trabajo se estudiaron los constituyentes del extracto hexano de las partes aéreas de plantas adultas y se reinvestigaron las lactonas del extracto cloroformico.
MATERIALES Y MÉTODOS
General. Para el aislamiento de los compuestos se empleó HPLC en fase reversa con detector de índice de refracción diferencial. Las columnas usadas fueron : (A) columna Beckman C18(5mm, 10 x 250 mm) y (B) columna Phenomenex Maxsil 10C8 (10mm, 10 x 500 mm). Los tiempos de retención (tr) fueron medidos desde el pico de solvente. Los espectros de 1H-RMN fueron determinados a 300 MHz en deuterocloroformo como solvente.
Material Vegetal. Partes aéreas de X. cavanillesii Schouw. fueron colectadas en Enero de 1994 en los alrededores de Simoca, Provincia de Tucumán. El material fue identificado por el Lic. Alberto Slanis del Instituto Miguel Lillo, Tucumán.
Extracción y Aislamiento. Hojas y algunos frutos (250 g) fueron extraídos con CHCl3 (2x4 l) a temp. ambiente por 5 días para dar 24 g de extracto crudo que fue suspendido en EtOH (400 ml) a 55°C, diluido con H2O (300 ml) y extraído sucesivamente con hexano (3 x 300 ml) y CHCl3(3 x 300 ml).
La evaporación del extracto hexano dio 12.1 g de residuo, una porción del cual cual (7 g) fue cromatografiado por columna (CC) de Silica gel (Sigel) empleando mezclas de hexano con cantidades crecientes de éter (10-40 %). Las fracciones fueron monitoreadas por TLC. Las fracciones con Rf similar a ß-amirina fueron reunidas y procesadas por HPLC empleando la columna A con MeOH absoluto a 2 ml/min como eluyente, para dar lupeol (2) (27 mg, tr 28 min), β-amirina (3) (6 mg, tr 39 min) y 24-metilencicloartanol (1) (2 mg, tr 40.5 min). Las fracciones con Rf similar al colesterol fueron reunidas y procesadas por HPLC como antes para dar stigmasterol (4) (5.5 mg, tr 34 min), campesterol (5) (1.5 mg, tr 35.5 min) y sitosterol (6) (14 mg, tr 40 min).
La evaporación a presión reducida del extracto CHCl3 dió un residuo (8.5 g) que fue cromatografiado por columna de Sigel (250 g) empleando CHCl3 con cantidades crecientes de MeOH (0-7 %) para dar 45 fracciones que fueron monitoreadas por TLC.
Las fracciones 15-21 fueron combinadas (291 mg) y procesadas por HPLC usando primero la columna B (MeOH-H2O 9:7,2 ml/min) y luego la columna A (MeOH-H2O 1:1,2 ml/min) para dar 4 mg de 13, 5 mg de 9 y 40 mg de 7. La fracciones 22-23 fueron reunidas (2.9 g) y una porción (402 mg) procesada por HPLC del mismo modo que antes para dar 2 mg de 12, 9 mg de 8, 14 mg de 10, 4 mg de 9, 101 mg de 7, 5 mg de 11 y 203 mg de una mezcla compleja de xanthanolidos. Combinación de fracciones 34-41 (251 mg) seguido de procesamiento por HPLC (columna A, MeOH-H2O l:l) dió 15 mg de loliolide (14). 19 mg de 8, 11 mg de 10 y 9 mg de 9.
RESULTADOS Y DISCUSIÓN
La cromatografía en columna (CC) del extracto hexánico rindió fracciones con Rf similar a (β-amirina (triterpenos) y colesterol (esteroles), respectivamente, las que fueron procesadas por HPLC en fase reversa.
De la fracción conteniendo triterpenos se aislaron 24-metilencicloartanol (1), lupeol (2) y β-amirina (3), mientras que la fracción conteniendo fitosteroles rindió stigmasterol (4), campesterol (5) y sitosterol (6).
Los compuestos 2-6 fueron identificados por los datos de RMN protónica, espectros de masa (EM) y puntos de fusión.
Por su parte, no se encontraron datos de RMN protónico para el 24-metilencicloartanol (1). Los datos físicos informados en la literatura para 1 son 4: p.f. 121-122°C; [a]D 43° (CHCl3). La muestra aislada por nosotros se presentó inicialmente como una goma que pudo inducirse a cristalizar con alguna dificultad después de varios intentos. El p.f. determinado estuvo de acuerdo con el reportado. El espectro de masa mostró el ion molecular a m/z 440 (M+, 1.2 %) de acuerdo con la fórmula C31H52O. Los restantes datos del EM y los datos de RMN protónica se dan a continuación:
24-Metilencicloartanol (1). EI-MS (70 eV) m/z (int.rel. %) 440 (M+, 1.2), 425 (1.9), 423 (1), 422 (2.7), 407 (3.7), 379(2), 353 (1.1), 341 (1.1), 325 (1.4), 300 (4.5), 279 (4.5), 203 (8), 175 (14), 167 (15.5), 149 (60), 121 (23), 109 (28), 97 (33), 95 (44), 81 (56), 69 (100), 55 (84), 43 (84) y 41 (59). 1H-RMN (200 MHz, CDCl3):d4.72brs 4.67brs (1H c/u,H2-31),3.29 dd (lH,J= 10.5 y 5.0 Hz,H-3), 1.05d y 1.04d (3H c/u, J=7, Me-26 y Me-27), 0.98s (6H, Me-18 y Me-29), 0.91d (3H, J=6.2, Me-21), 0.92s (3H, Me-28), 0.83s (3H, Me-30), 0.55d y 0.33d (1H c/u, J=4.3, H2-19).
El espectro protónico de 1 mostró señales típicas para un metileno de ciclopropano a 0.55 y 0.33 ppm, ambas como dobletes con acoplamiento geminal de 4.3 Hz. Los protones del metileno vinílico de C-31 aparecieron como singletes anchos a 4.72 y 4.67 ppm, mientras que el protón carbinólico de C-3 apareció como dd a 8 3.29 ppm con J1 = 10.5 Hz y J2 = 5 Hz. Las señales correspondientes a los grupos metilos fueron asignadas por sus multiplicidades y por comparación con los valores reportados en la literatura para compuestos similares : δ 1.05 d y 1.04 d (3H cada una, J=7, Me-26 y Me-27), 0.91d (3H, Me-21), 0.83s (3H, Me-30), 0.98s (6H, Me-18 y Me-29) y 0.92s (3H, Me-28).
El extracto cloroformo de las partes aéreas de X. cavanillesii mostró una intensa absorción en el infrarrojo a 1770 cm-1 indicando la presencia de λ-lactonas. Se conoce que las especies de Xanthium producen un tipo especial de seco-ambrosanolidos denominados xanthanolidos5-8 lo que facilitó la identificación estructural de los compuestos aislados. La principal lactona del extracto fue xanthumin (7) seguida por su 11,13-dihidroderivado (9) que no había sido reportado previamente en la literatura6. Otras lactonas aisladas como componentes menores fueron 2-hidroxitomentosin (8)9, el epóxido (10)9, su dihidroderivado (11)8, el nuevo bis-norxanthanolido (12)6, 8-epi-xanthatin (13)10 y loliolide (14)11.
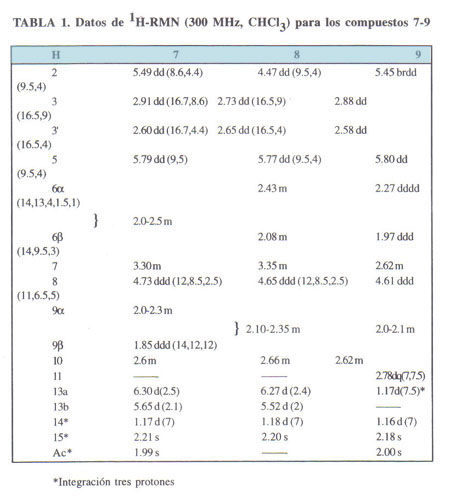
La estructura de 7 fue establecida rápidamente por los datos de 1H-RMN (Tabla 1) y comparación con los datos de la literatura. El desacetil derivado 8, llamado hidroxitomentosin9, mostró un espectro similar al de 7 con el esperado corrimiento a campos mas altos para la señal de H-2 (d 4.47 ppm) y la desaparición de la señal de acetato (Tabla 1). Del mismo modo, el espectro protónico de 9 mostró que se trataba del 11,13-dehidro derivado de xanthumin (7), debiendo destacarse el acoplamiento homoalítico de H-6α con H-2 (ca. 1 Hz) y con H-10 (ca. 1.5 Hz).
La estereoquímica del Me-13 fue deducida como β en base al valor J7,11 j= 7Hz que indica que dichos protones se encuentran cis el uno respecto del otro.
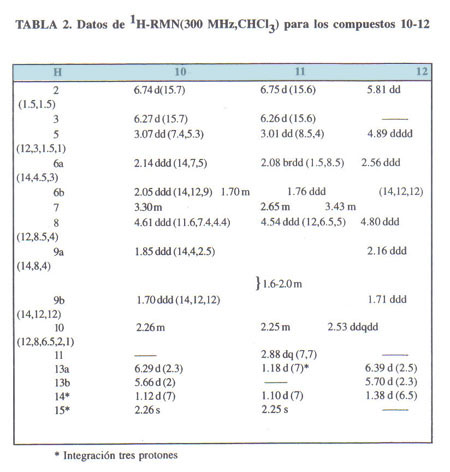
La presencia de un 4,5-epóxido en 10 fue indicada por el dd a δ 3.07 el cual estaba acoplado con dos ddd a δ 2.14 y 2.05 (Tabla 2). Experimentos de DR y COSY permitieron la asignación de todas las señales. La configuración β-epóxido en 10 fue asignada en base a la magnitud de los acoplamientos 5,6α y 5,6β y el uso de modelos moleculares. Apoyo adicional a la configuración asignada surgió de la comparación con dos epóxidos similares aislados de Xanthium spinosum13.
El espectro H-RMN de 11 indicó claramente que se trata del 11,13-dihidro derivado de 10 por la aparición de un doblete que integra para 3 protones a δ 1.18 ppm (J= 7Hz) en reemplazo de las señales correspondientes al exo-metileno. La configuración β para el Me-13 deriva del valor de J7,11 = 7Hz.
El bis-norxanthanolido 12 fue aislado en muy pequeña cantidad. Su estructura fue asignada en base al espectro de masas por ionización química que mostró un ion cuasi-molecular a m/z 235 [M+ + H]+ (int. relativa 100 %) de acuerdo con la fórmula C13H14O4 y los datos del 1H-RMN. La similitud de los valores de acoplamiento de H-7, H-8 y H-10 con los correspondientes a xanthumin (7), hidroxitomentosin (8) y 11,13-dihidroxanthumin (9) indican que la lactona 12 también esta lactonizada cis con el Me-14 en posición β. Por otra parte, H-5 se ubicó en posición α para justificar los significativos acoplamientos alílicos observados entre H-2 y H-5; H-2 y H-10; H-5 y H-10 y los acoplamientos vecinales entre H-5 y H-6α y H-5 y H-6β.
Los datos de 1H RMN de los compuestos 7-12 están resumidos en las Tablas 1 y 2.
Finalmente se aislaron 8-ePI-xanthantin (13)10 y el sesquiterpeno degradado loliolide (14)11 que fueron identificados por comparación con los datos espectroscópicos reportados en la literatura.
|
CONCLUSIONES
La química de X. cavanillesii está de acuerdo con la reportada para otras especies del género5-13 que típicamente producen un tipo especial de seco-ambrosanolidos denominados xanthanolidos cuyo esqueleto sesquiterpénico corresponde a los compuestos 9-11 y 13 . La lactona 8-epi-xanthatin (13)10 se adiciona a los xanthanolidos reportados previamente en esta planta6. Notablemente, X. cavanillesii produce dos sesquiterpenos degradados: el bis-norxanthanolido 126 y loliolide (14)11.
Los esteroles identificados fueron stigmasterol (4), campesterol (5) y sitosterol (6), todos ellos ampliamente difundidos en el reino vegetal. Los triterpenos aislados fueron el raro 24-metilencicloartanol (1) para el que se reportan por primera vez los datos de masa y 1H RMN, además de lupeol (2) y β-amirina (3).
Los extractos hexano y cloroformo de las partes aéreas de plantas adultas de X. cavanillesii mostraron escasa a moderada actividad sobre la germinación de semillas de Lactuca sativa. Las plantas adultas son rechazadas por los herbívoros, debido probablemente al alto contenido de lactonas sesquiterpénicas que le confieren un sabor muy amargo.
Agradecimientos: este trabajo fue realizado con subsidios otorgados por el Consejo de Investigaciones de la Universidad Nacional de Tucumán (CIUNT).
|
|
|