
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
VIII CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XV - 1994 - pág 315 a 319.
RESUMEN
El presente trabajo esta dirigido a la búsqueda de nuevos y más eficaces antioxidantes de origen natural a partir de plantas de la medicina tradicional argentina. Se midió la capacidad antioxidante de las infusiones liofilizadas de 15 plantas medicinales argentinas. La misma se determinó por el ensayo de inhibición de la quimioluminiscencia en homogeneizado de hígado de rata sometidos a estrés oxidativo. Seis infusiones mostraron una actividad antioxidante significativa en un rango de 10 a 1000 ug de extracto seco/ml, de estas infusiones se determinó el valor de IC50.
The present work deals with the search for new and more efficient natural antioxidants in plats used in traditional argentine medicine.The antioxidant activities of lyophilized infusions of 15 Argentine medicinal plants were studied using the hydroperoxide-initiate chemioluminiscence assay in liver homogenates. Six infusions were found to have an effective antioxidant activity in the range 10-1000 ug dry weight/ml and their IC50 was determined.
INTRODUCCIÓN
El reino vegetal representa un enorme reservorio de moléculas bioactivas aún no descubiertas. Se estima que el número de especies vegetales existentes se encuentra entre 500.000 y 700.000. Del total, sólo se conocen 250.000 y sólo un pequeño porcentaje ha sido investigado fitoquímicamente, y aún una fracción menor ha sido sometida a ensayos biológicos o farmacológicos.
Existe actualmenteun renovado interés en la búsqueda de compuestos activos naturales para encontrar nuevos agentes terapéuticos para nuevas enfermedades o para reemplazar aquellos que con llevan un sinnúmero de efectos adversos indeseables. La fuerte evidencia respecto a la implicancia de los procesos oxidativos en el origen de numerosas enfermedades y procesos de envejecimiento celular, ha determinado la necesidad de encontrar nuevos y más potentes antioxidantes para mejorar la calidad de vida y prevenir diversas patologías relacionadas con las especies activas del oxígeno producidas durante el estrés oxidativo.
Los radicales del oxígeno son generados en los sistemas biológicos o del catabolismo xe-nobiótico (Chance et al, 1979). Estos radicales libres del oxígeno y otras especies reactivas derivadas de ellos inducen un daño peroxidativo a las biomembrenas celulares y también a biomoléculas no lipídicas tales como el DNA, conduciendo a un daño tisular (Merry et al., 1989; Halliwell et al., 1992; Halliwell and Aruoma, 1991). Los antioxidantes pueden cooperar con el sistema de defensa y han sido propuestos para el uso en un gran número de enfermedades incluyendo ateroesclerosis y diferentes tipos de carcinoma (Sies, 1991). Por otra parte en la industria alimentaria es cada vez más frecuente el uso de antioxidantes de origen natural en reemplazo de los de síntesis química que son consumidos en cantidades aprecia-bles y de los cuales existe evidencia de problemas de toxicidad (Al Jay et al., 1987; Pollack and Morse, 1988).
En la presente investigación, fuero estudiadas las infusiones liofilizadas de 15 plantas medicinales argentinas. La capacidad antioxidante fue determinada por el ensayo de inhibición de la quimioluminiscencia iniciada por hidroperóxido de terbutilo (f-BuOOH) en homogeneizado de hígado de rata.
MATERIALES Y MÉTODOS
Material vegetal. El material vegetal fue recogido de su habitat natural en distintas provincias de la Argentina. La identificación fue realizada por botánicos del Museo de Farmacobotánica-"Juan A. Domínguez" de la Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Los correspondientes ejemplares de herbario se encuentran depositados en la misma institución.
Reactivos: El hidroperóxido de terbutilo (f-BuOOH) y la catequina utilizadas fueron de Sig-ma Chemical Co. (St. Luis, MO).Los reactivos utilizados fueron de grado analítico.
Preparación de extractos. A 5 g del polvo del material vegetal se le agregaron 100 mi de agua a ebullición en un erlenmeyer con tapa. Se dejó reposar durante 20 min. y se filtró Los extractos acuosos obtenidos fueron liofilizados.
Preparación de los homogeneizados de hígado de rata. Ratas Wistar adultas de 180-200 g de peso fueron alimentadas con la dieta de laboratorio y agua ad-libitum. Los hígados fueron extraídos y homogeneizados con 120 mM KC1 y 50 mM de buffer fosfato, pH 7.4, (1:10, peso/volumen). Las muestras fueron centrifugadas a 700 rpm durante 10 minutos a 0-4°C. La fracción sobrenadante fue separada y conservada a -20°C antes de ser usadas.
Determinación de proteínas: Las proteínas fueron determinadas por el método de Lowry et. al. (1951), utilizando seroalbúmina bovina como standard.
Quimioluminiscencia iniciada por hidroperóxido. La quimioluminiscencia iniciada por hidroperóxido en homogeneizado de hígado de rata (González Flecha et. al, 1991) fue medido en un contador de centelleo líquido modelo LKB Wallac 1209 Raekbeta con el circuito de coincidencia desconectado, en el canal de tritio y a 30 °C. Los homogeneizados de hígado de rata fuero ajustados a una concentración final de proteína de 0.5 mg/ml en 120 mM KC1, 50 mM de buffer fosfato, pH 7.4 y 2 mi de volumen final fueron colocados en tubos de vidrio de 10 mm de diámetro x 35 mm de altura, los cuales fueron colocados en viales de bajo contenido en potasio de 25 mm de diámetro x 50 mm de altura. Los extractos acuosos, solubili-zados en agua destilada, fueron agregados al medio de reacción en concentraciones de 1000, 100 y 10 ug de peso seco/mi. La quimioluminiscencia fue iniciada por adición de í-BuOOH 3 mM y fue expresada como cps/mg de proteina. Los valores de de inhibición de la quimioluminiscencia se expresan como la relación entre la máxima emisión en presencia de extracto y en ausencia de extracto (control). Se usó catequina como control positivo debido a su alta actividad antioxidante (Fraga et al, 1987). El método estadístico usado para el cálculo de concentración de extracto que inhibe el 50 % de la quimioluminiscencia fue el de Finney, 1971.
RESULTADOS Y DISCUSIÓN
Se midió la capacidad antioxidante de los extractos acuosos liofilizados de 15 plantas medicinales Argentinas, usando el ensayo de inhibición de la quimioluminiscencia inducida por hidroperóxido de íer-butilo. Este ensayo ha sido previamente usado por Fraga et al, 1987 para determinar la actividad antioxidante de una serie de polifenoles naturales y permite determinar la capacidad atrapadora de radicales libres en reacciones en cadena.
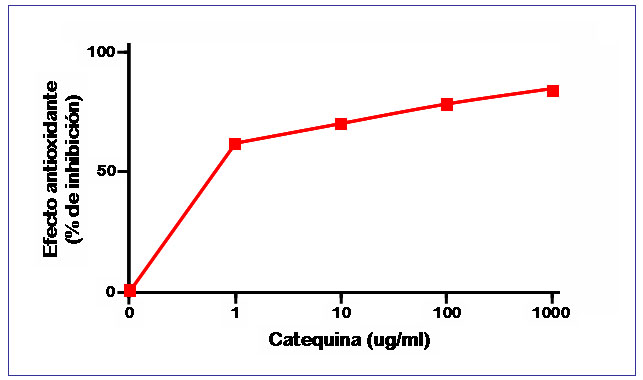
Los efectos antioxidantes fueron medidos en tres concentraciones de extracto acuoso 10, 100 y 1000 ug/ml y fueron expresados como porcentaje de inhibición de la quimioluminiscencia (Tabla 1), evaluados a la máxima emisión (Cadenas y Sies, 1982), los resultados de inhibición, matemáticamente expresados como negativos, significan un aumento de la quimioluminiscencia. Se utilizó catequina como control y standard de actividad, por tratarse de uno de los productos naturales con mayor actividad antioxidante (Fraga et al, 1987), mostrando una IC50 cercana a 1 ug/ml (Fig.l).
Se determinaron los valores de ICSO en aquellas especies cuyos extractos demostraron capacidad antioxidante en todas sus concentraciones (Tabla 2). A. australe resultó ser la más activa con 50 % de inhibición a 123 ug/ml, mientras que B. crispa alcanza dicha inhibición a 544 ug/ml. Se continua con el estudio de estas seis especies tendientes al aislamiento e identificación del o los compuestos con actividad antioxidante presentes en las infusiones.
Los extractos acuosos de dos de las especies evaluadas, B. grisebacchi y T. trilfora mostraron un aumento de la quimioluminiscencia en todas las concentraciones ensayadas (expresado como valores negativos) y siete especies en una o dos concentraciones de mayor dilución 10 ug/ml y 100 ug/ml. La evaluación de estos resultados debe ser cuidadosa, pudiendo proponerse el aumento de la quimioluminiscencia como una evaluación de actividad prooxidante. Haciéndose necesario la combinación con otros ensayos para corroborar dicha actividad.
| Acanthospermum australe (Loefl) O. Kze. | |||
| Achyrocline satureoides (Lam.) D.C. | |||
| Baccharis coridifolia D.C. | |||
| Baccharis crispa Spr. | |||
| Baccharis grisebachii Hieron. | |||
| Baccharis tucumanensis H. et A. | |||
| Baccharis articulata (Lam.) Per. | |||
| Gentianella achalensis (Gilg.) T.N. & S.W. Liu | |||
| Gentianella florida (Griseb) Holub. | |||
| Gentianella riojae (Griseb.) Fabris | |||
| Pluchea sagitalis (LaM.) Cabr. | |||
| Pterocaulon polystachium D.C. | |||
| Pterocaulon purpurascens Malme | |||
| Pterocaulon virgatum (L.) D.C. | |||
| Terminalia triflora (Grisb.) Lillo | |||
La inhibición de la quimioluminiscencia fue calculada por [l-Etm-Etp)(Ecm-Ecp)] x 100; Etm y Etp = intensidad de emisión de las muestras a la máxima emisión; Ecm y Ecp= intensidad de emisión del control a la máxima emisión.
Los valores negativos de inhibición representan un incremento de la luz emitida comparado con los controles.
95% (ug/ml) |
||
| Acanthospermum australe (Leofl.) O. Kze. | ||
| Achyrocline satureoides (Lam.) D.C. | ||
| Baccharis coridifolia D.C. | ||
| Baccharis crispa Spr. | ||
| Pterocaulon polystachium D.C. | ||
| Pterocaulon purpurascens Malme. |
|
|
|