
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
VIII CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XV - 1994 - pág 289 a 294.
RESUMEN
Melia azederach "paraíso" es una angiosperma exótica de importancia forestal, con rápido crecimiento y alta resistencia al ataque de insectos. Posee principios activos con actividad insectífuga y parasiticida. El cultivo de tejidos vegetales in vitro puede suministrar en forma continua y homogénea materia prima para obtener compuestos de interés. El objetivo de este trabajo fue ajustar una metodología para la producción de callos de "paraíso" para la obtención de principios activos con actividad insectífuga.
Se obtuvieron callos en un medio de cultivo conteniendo los macro y micronutrientes de Greesshoff & Doy completos, adicionados con 30 gr/l de sacarosa, 8gr/l de agar, vitaminas de Jacquiot, 3ppm de ANA y 1 ppm de BAP. Las condiciones ambientales de cultivo fueron 16 hs. de luz u oscuridad completa, a 21°C ± 1-2°C. Se utilizaron diferentes explantes provenientes de árboles adultos, semillas y plántulas.
SUMMARY
A great callus production was obtained from different explants in a medium of Greesshoff & Doy with 3 o/o sucrose, 0.8% agar, Jacquiot vitamins, 3 ppm. BAP and 1 ppm. NAA. Culture conditions were 21°C +/- 2°C with 16 hs. daylenght or completely darkness.
INTRODUCCIÓN
Los insectos pueden comportarse como plagas o pestes afectando a las personas, animales y cultivos. Para defenderse de ellos, el hombre utiliza sustancias insecticidas o insectífugas que pueden ser productos naturales o sintéticos (pesticidas órgano clorados y órgano fosforados). El uso inadecuado de éstos últimos ha conducido a intoxicaciones en animales y humanos de graves consecuencias, además de generar problemas ecológicos y ambientales. Esto ha llevado a utilizar nuevamente compuestos de origen natural.
Las propiedades insecticidas o insectífugas que poseen muchas especies vegetales pueden utilizarse en programas de Control Integrado de Plagas, con el objeto de respetar el equilibrio ecológico y mejorar la calidad de vida. Un ejemplo de esto es el empleo de Melia azederach en huertas familiares.
Conocido con el nombre común de "paraíso", es una de las latifoliadas exóticas de rápido crecimiento con mayores posibilidades de difusión en los distintos ambientes de la Argentina (Abedini et al, 1991). En la actualidad existen más de 7.500 ha de bosques implantados con esta especie ya que reviste gran importancia en la industria maderera. Presenta alta resistencia al ataque de insectos y sus hojas y flores machacadas se utilizan para repeler vinchucas, pulgas y mosquitos. La decocción ha sido utilizada en la lucha contra la langosta; posee derivados del azufre característicos. La corteza se emplea como antihelmíntico en forma de cocimiento en dosis de 1 a 4 gr. Los frutos maduros y secos se utilizan como parasiticida externo y repelente de la polilla (Trease y Evans, 1976).
Actualmente, la extracción de principios activos de las plantas se aplica para aquellos compuestos que no pueden ser sintetizados químicamente por su complejidad o por su alto costo. Es importante destacar que algunas especies presentan problemas particulares que dificultan el uso de un compuesto en particular. Tal es el caso de la Cincharia officinalis y C. ledgeríana, de cuyas corteza se extrae la quinina, ya que hay que esperar aproximadamente 21 años para que la planta llegue a la edad adecuada para su extracción. Otro inconveniente que pueden presentar los vegetales es el bajo contenido de un compuesto de interés en particular, lo que dificulta su extracción y por lo tanto eleva su costo.
Existen además, dificultades consecuentes, tales como la sobreexplotación a que se puede ver sometida una especie en particular (como ejemplo podemos citar el caso de Dioscorea composita) y una serie de problemas de industrialización, como es el suministro constante de materia prima, ya que este puede volverse errático debido a las condiciones ambientales. Además, las plantas deben ser mantenidas fisiológicamente activas durante el transporte y almacenamiento para asegurar altos rendimientos, aún cuando se cultiven o extraigan de lugares alejados. A esto puede agregarse el problema adicional de la domesticación de plantas silvestres, pues generalmente en las plantas cultivadas el contenido de metabolitos secundarios disminuye. Aún cuando se ha intentado el fitomejoramiento, el incremento en el rendimiento se ha logrado en muy pocos casos. Se le suma a lo mencionado el problema de la heterogeneidad natural de las plantas, lo que provoca variación en el contenido del producto de interés (Loyola Vargas et al., 1985).
Desde hace algunos años se han buscado soluciones a los problemas expuestos. Una de las alternativas más promisorias es el cultivo de tejidos vegetales in vitro. Esta técnica puede proveer un suministro constante y homogéneo de materia prima en un estadio fisiológico uniforme, debido a las condiciones controladas utilizadas para su crecimiento, además de facilitar la manipulación del material vegetal. (Loyola Vargas et al., 1985).
Los principios activos pueden extraerse también a partir del cultivo de callos y de células en suspensión. Esta técnica ya es utilizada para obtener otros productos con actividad insecticida, como es el caso del piretro a partir del cultivo in vitro de Chrysantemun sinerariaefolium y Pirethrum sp. (Robert et al., 1989).
El objetivo de este trabajo es ajustar una metodología de producción de callos por cultivo in vitro de Melia azederach L. para la obtención de productos con actividad insectífuga.
MATERIALES Y MÉTODOS
Elección de la fuente donante de explantes
Se realizó un screening de plantas madres adultas y semillas ubicadas en el Campo Experimental de la F.C.A. y F. y en el Jardín Botánico de la UNLP. Se evaluaron las respuestas a su cultivo in vitro (formación de callo, tasa de crecimiento, grado de contaminación).
Tipo de explante
Se probaron las respuestas de diferentes tipos de explante: tallo (secciones nodales, internodales, corteza forestal, ramas jóvenes, ramas lignificadas), hojas (limbo, pecíolo), inflorescencias maduras e inmaduras (raquis y flores), frutos inmaduros, yemas en actividad y durmientes, brotes del año y algunos tejidos aislados, como epidermis, parénquima cortical y me-socarpos. Además se utilizaron semillas y secciones de plántulas (sin radícula).
Acondicionamiento y desinfección del explante
El material recolectado a campo fue lavado con agua corriente durante 24 hs. Los órganos lignificados fueron tratados, además, con alcohol o agua oxigenada. Luego de ésto, para lograr la desinfección del material vegetal utilizado y evitar su contaminación in vitro, se utilizaron diferentes agentes desinfectantes, en distintas secuencias, concentraciones y tiempos de inmersión.
Cuadro 1: Agentes desinfectantes, concentración y tiempos de exposición.
| Desinfectante | ||
| Hipoclorito de Sodio | ||
| Etanol | ||
| Bicloruro de Mercurio | ||
| Fungicidas | ||
| Antibióticos | ||
| Tween 20 - Extran | ||
| Solución jabonosa | ||
| DG6 - Pervinox-alcohol iodado | ||
| - | ||
| Antibióticos: Poenbioptal, Nistatina, Penicilina, Cloranfenicol, Gentamicina. Fungicidas: Captan, Benlate, Dithane. |
||
Medios de cultivo
Para esta especie se probaron los medios básales de: Murashige y Skoog (1962), Gresshoff y Doy (1972), Cheng (1975) y Woody Plant Médium (Lloyd & McCown,1980).
Todos estos medios se utilizaron en concentración completa, a la mitad y un cuarto de sus macro y micronutrientes. Los medios fueron esterilizados en autoclave a 120° C, durante 20 minutos a 1 atmósfera de presión. El pH fue ajustado a 5,8- 6,0. Se colocaron en Erlenmeyer de 250 mi conteniendo 50 mi de medio cada uno. Se solidificaron con Difco-Bacto agar (6.5 - 8 gr/l).
Cuadro 2: Reguladores de crecimiento utilizados, tipo y concentración.
| - | Auxinas | Citocininas | Gibelerinas |
| Tipo | 2,4D, ANA, AIA, IBA | BAP, Kin, Zea | AG3 |
| Concentración | 9,1 a 10 ppm | 0,01 a 10 ppm | 0,5 a 5 ppm |
Condiciones ambientales de cultivo
Los explantes sembrados bajo campana de flujo laminar se colocaron en cámara climatizada a 21°C +/- 2°C, con un fotoperíodo de 16 horas o en oscuridad. Se utilizaron tubos Biolux con una irradiancia de 140 μE m-2 s-1.
Observaciones
Se realizaron observaciones microscópicas (desdiferenciación celular) y macroscópicas (grado de contaminación, formación de callo, crecimiento, morfogénesis).
RESULTADOS y DISCUSIÓN
Melia azederach se presenta como una especie de relativa facilidad para formar callo bajo las condiciones testeadas. No se encontró variación en la respuesta a su cultivo in vitro, de los distintos individuos seleccionados como fuente donante de explantes. Todos los explantes ensayados reaccionan formando callo. Esta respuesta varía de acuerdo a la época del año, tipo de tejido y medio de cultivo. Es así como en primavera-verano todos los explantes forman callo con una tasa de proliferación celular acelerada; en otoño-invierno, la capacidad de desdiferenciación y proliferación celular disminuye, aumenta la tasa de contaminación y algunos tejidos directamente no responden al cultivo in vitro. Esto ha sido observado por otros investigadores para especies diferentes (López Peralta, 1979).
Los mejores resultados (0-20% de contaminación principalmente con hongos) en la desinfección de material adulto se obtuvieron con el siguiente protocolo:
| Agua + Nistatina | 2 h |
| Etanol 70% | 2 min |
| Bicloruro de Hg | 2 min |
| Hipoclorito de Na 30% | 10 min |
| lavado con agua + Gentamicina | - |
Los callos se necrosan si el tiempo de subcultivo a medio fresco es superior a 60 días. Los explantes más adecuados fueron la sección internodal de ramas jóvenes y las hojas. Las plántulas y semillas también forman callo fácilmente, pero quizás tengan menos posibilidades de generar metabolitos secundarios, ya que los principios activos en esta especie se encuentran en los órganos diferenciados.
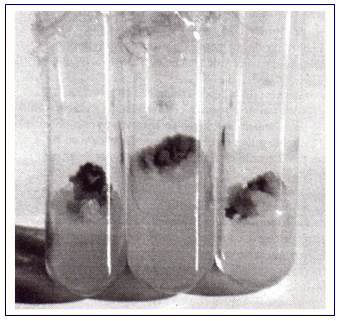
Callos cultivados in vitro de Melia azederach C.E. - Pro.Ve, 1994.
Estos callos corresponden a la inducción de desdiferenciación en explantes de secciones internodales de ramas jóvenes de individuos adultos (30 días de cultivo).
|
|
|