
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
VIII CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES
Volumen XV - 1994 - pág 21 a 30.
RESUMEN
El aceite esencial de las hojas de Melaleuca leucadendron L., se extrajo por hidrodestilación y se analizó por cromatografía de gases espectrometría de masas (CG-EM). Resultó biológicamente activo contra Staphylococm aureus y Bacillus cereus e inocuo frente a Sitophylus oryzae y Tribolium castaneum. Los principales compuestos presentes en este aceite son 1,8-cineol (38%), nerolidol (29%), alloaromadendreno (14%) y α-terpineol (13%), materias primas de las industrias farmacéuticas, cosmetológicas y de perfumes. El canfeno, benzaldehido, mirceno, 3-careno, γ-terpineno, terpinoleno, benzoato de metilo, dehidrocarveol, ácido cinámico, ocimeno, 4-hidroxi-2-metilacetofenona, isoeugenol, α-farneseno, espatulenol y benzoato de bencilo se identificaron como constituyentes no reportados anteriormente. Asimismo, se identificaron tentativamente 3,7-dimetil-l,3,7-octatrieno, 4-careno, 5-caranol, γ-terpineol, β-maalieno, isocariofileno, γ-gurjuneno, α-cariofileno, eremofileno, α y γ-muuroleno, β-elemeno, sativeno, ledeno, ledol, ocho sesquiterpenos, un sesquiterpenol, y α-bisabonol como compuestos no citados en aceites de esta especie de otras regiones.
The essential oil was extracted from the leaves of Melaleuca leucadendron, by hydrodistillation and analyzed by gas chromatography-mass spectrometry (CG-MS). This oil showed biological activity against Staphylococus aureus and Bacillus cereus and it was not active against Sitophylus oryzae and Tribolium castaneum. The major compounds present in this oil are 1,8-cineole (38%), nerolidol (29%), alloaromadendrene (14%) and α-terpineol (13%), which are used in the pharmaceutical industry and the manufacturing of perfumes and cosmetics. Camphene, benzaldehyde, myrcene, 3-carene, α-terpinene, terpinolene, methyl ester benzoic acid, dehydrocarveol, cinnamic acid, ocimene, 4-hydroxy-2-methyl-acetophenone, isoeugenol, α-farnesene, spathulenol and bencyl ester benzoic acid were identified as new constituents in this oil; 7-dimethy 1-1,3,7-octatrieno 4-carene, 5-caranol, γ-terpineol, β-maaliene, isocaryophyllene, γ-gurjunene, α-caryophyllene, α and γ-muurolene, β-elemene, sativene, ledene, ledol, eight sesquiterpenes, one sesquiterpenol and α-bisabonol were also tentatively identified.
INTRODUCCIÓN
Los aceites esenciales, esencias, aceites volátiles o aceites etéreos son mezclas de sustancias volátiles de diferente polaridad que se producen en ciertas familias de plantas1-3. Desde tiempos remotos el hombre ha utilizado las esencias para múltiples propósitos, entre lo que se destacan: comercio de perfumes4, embalsamar5, efectos antimicrobianos6 y quimiotaxonomía7-8. Melaleuca leucadendron L. es un árbol de hasta 40 metros de alto, con el tallo cubierto de súber laminado. Esta especie se encuentra diseminada en Australia, Nueva Guinea e Indonesia, y con gran adaptación a algunas regiones del suroeste de Venezuela (Rubio, Estado Táchira). El aceite esencial de las hojas de diferentes especies de Melaleuca posee propiedades farmacéuticas y antimicrobianas9, ha sido analizado por cromatografía de columna, por cromatografía gas-líquida11-13 y por cromatografía de gas-espectrometría de masas14-19. Los resultados obtenidos por esas técnicas para el aceite de una misma especie son discrepantes en cuanto al número, tipo y cantidades de constituyentes. Este trabajo versa sobre las propiedades fisicoquímicas, actividad biológica sobre microorganismos e insectos (coleópteros), ensayo de toxicidad y la separación e identificación por cromatografía de gases espectrometría de masas de los constituyentes del aceite esencial de la citada especie venezolana20.
MATERIALES Y MÉTODOS
Se emplearon hojas recién cosechadas de Melaleuca leucadendron de Rubio, Estado Táchira, Venezuela. Se empleó un hidrodestilador industrial para la extracción del aceite esencial. La determinación de constantes físicas se llevó a cabo con picnómetros, un refractómetro Baush and Lomb-Abbe 3L y un polarímetro Alago Polax D. Para la separación y estimación de compuestos se usaron dos cromatógrafos de gases Perkin Elmer: un modelo Autosystem con detector FID y columna OV-17 de 50 m y 0.32 mm x 0.25 mm, y el otro modelo Autosystem acoplado a Espectrómetro de Masas Q Masas 910 de la misma marca, con columna capilar de metil 5% fenil silicona de 30m x 0.25mm. Los patrones de constituyentes de aceites esenciales, así como otros reactivos de grado analítico se adquirieron en casas comerciales de prestigio reconocido.
Extracción y almacenamiento: La extracción del aceite esencial de hojas frescas (20 kg) se realizó por hidrodestilación durante 4 horas. El aceite se colectó sobre agua en una trampa de Clevenger, después de separarse el aceite se secó con sulfato de sodio anhidro, se protegió de la luz y se guardó bajo refrigeración (6° C) para posteriores análisis.
Caracterizaron del aceite esencial: La densidad, índice de refracción y la rotación específica se determinaron a 22 °C, empleando aceite sin diluir. La polarimetría se realizó empleando luz monocromática de sodio a 578 nm y un tubo polarimétrico de 10 cm.
Determinación del número de componentes: Para separar y estimar el número de constituyentes del aceite esencial, se empleó la cromatografía de gases21. Se utilizó una columna OV-17 de 50 metros de largo y 0.32mm de diámetro. El análisis se realizó regulando el inyector a 200°C e inyectando 0,6 ml de aceite con reparto 40:1, detector de ionización a la llama (FID) a 250°C, gas portador nitrógeno (V= 25 cm/s). El programa utilizado para el análisis fue el siguiente: 60°C isotérmico durante 3 minutos, luego se incrementó a razón de 4°C por minuto hasta 220°C y finalmente se mantuvo a 220°C durante 4 minutos. Los análisis cromatográficos se llevaron a cabo por triplicado para las muestras de aceite y para los patrones. El porcentaje promedio de desviación estandard para los picos individuales fue generalmente menor del 10%.
Identificación y cuantificación de componentes del aceite por cg/ms: Se empleó una columna capilar de metil 5% fenil silicona de 30 metros x 0.25mm x O.lOmm; el gas de arrastre fue He a 25 cm/s, con reparto 40:1. El programa del horno fue de 3 minutos isotérmico a 60°C, con un incremento de 4 °C por minuto hasta 200°C, temperatura que se mantuvo por 4 minutos más. Las temperaturas del inyector, de la línea de transferencia y del ionizador fueron de 200°C, 170°C y 180°C respectivamente. El voltaje de ionización fue de 70eV. El espectrómetro de masas se calibró con Perfluotributilamina (PTA) como patrón. Para el análisis se inyectó 0.6 ml del aceite puro. El equipo permite ver en pantalla y registrar el cromatograma de la muestra inyectada. Los picos correspondientes a los constituyentes trazas se estudiaron expandiendo el cromatograma. La asignación de identidad se realizó seleccionando cada pico, obteniendo su espectro de masa y comparándolo con el de la librería o base de datos NIST del instrumento. Esta base de datos además proporciona los posibles compuestos, su fórmula y porcentaje de coincidencia. Para reforzar la identidad de los constituyentes del aceite, se usaron algunos patrones disponibles, mediante cromatografía, es decir, disolver una pequeña cantidad de mezcla de patrones en el aceite, obtener el cromatrograma y compararlo con el del aceite sin patrones. El incremento de las áreas correspondientes a picos con igual tiempo de retención, se tomó como evidencia de identificación.
Porcentaje de los componentes del aceite esencial: Se hizo mediante el área de cada pico y el mismo se refirió al área total de los picos presentes en el cromatograma. Actividad biológica sobre microorganismos: Se realizaron ensayos de sensibilidad con cepas de Pseudomona aeruginosa, Escherichia coli, Staphylococus aureus y Bacillus cereus empleando soluciones etanólicas del aceite (1000 mg/ml). Se midieron (mm) los halos de inhibición que producen discos impregnados de aceite colocados sobre preparados de los microorganismos. Los halos de inhibición se midieron a las cero horas sin irradiar, hasta las 7 horas irradiando. La aparición de un halo alrededor del disco se tomó como evidencia de la actividad biológica del aceite contra los microorganismos estudiados.
Bioensayos sobre dos especies de insectos: Se emplearon dos especies de coleópteros: el Sitophylus oryzae y el Tribolium castaneum, ambos sobre sustratos de pasta de harina de trigo conteniendo entre 0.01 y 0.05 mg/cm2 del aceite esencial y 60 horas de exposición22OBJETIVOS
Caracterizar el aceite esencial de las hojas de Melaleuca leucadendron mediante sus propiedades fisicoquímicas, determinar sus constituyentes oxigenadas e hidrocarbonadas mediante cromatografía de gases-espectrometría de masas, así como también confirmar su actividad biológica ante insectos y microorganismos.
RESULTADOS Y DISCUSIÓN
La hidrodestilación de las hojas de Melaleuca leucadendron de varios especímenes ubicadas en el Suroeste de Venezuela, dio 1% de rendimiento de aceite esencial (en base a follaje fresco). En la Tabla 1 aparecen los valores de rendimiento, índice de refracción, rotación específica y densidad correspondientes al aceite vietnamés15 y al venezolano. Existe similitud entre el índice de refracción y la densidad, con ligera actividad dextrógira en el aceite venezolano, mientras el vietnamés es ligeramente levógiro. El rendimiento en base fresca es idéntico para los dos aceites.
η |
1 |
1,4739 |
1,4632 |
[η] |
1 |
-1,30 |
+2,47 |
d |
1 |
0,9061 |
0,8768 |
En la Tabla 2 se muestran los resultados que confirman la actividad biológica del aceite frente a los microorganismos ensayados. El aceite a O horas, es decir sin irradiar los discos, es moderadamente antibiótico contra Bacillus cereus pero no lo es contra Staphylococus aureus. Sin embargo, contra este último muestra que al empezar a irradiar los discos aparece un halo de inhibición de hasta 7 mm, por lo que el aceite se puede considerar que contiene uno o unos compuestos fototóxicos. El aceite mostró gran toxicidad sobre Artemia salina, teniendo su LC50 en 22,25mg/ml, lo cual indica la propiedad citotóxica de algunos de los compuestos del aceite.
Tiempos |
|||||
Stafilococcus aureus |
- |
3 |
7 |
7 |
7 |
Bacilus cereus |
2 |
3 |
4 |
4 |
4 |
Los resultados del bioensayo del aceite con dos especies de coleópteros Sitophyhus oryzae y Tribolium castaneum, se reseñan en la Tabla 3. El aceite no promueve cambios significativos de comportamiento en las dos especies estudiadas, no es tóxico aún en niveles apreciables y probablemente no es detectado por el sistema sensorial de los insectos analizados.
S. oryzae |
0% |
≤ 14,04 ± 2,10 |
No |
1,0 ± 0,04 |
T. castaneum |
0% |
≤ 7,40 ± 0,60 |
No |
0,40 ± 0,09 |
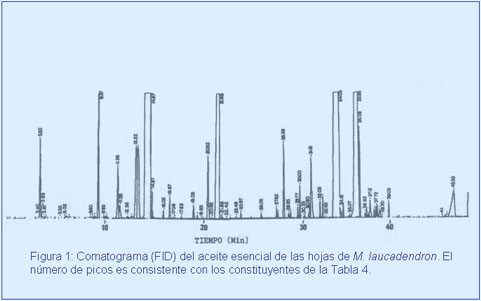
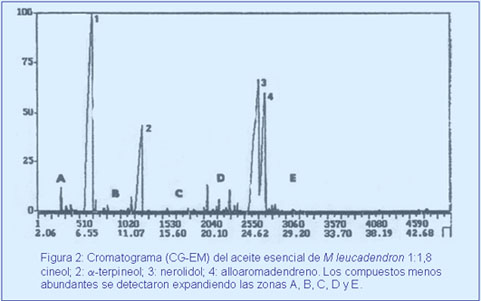
La cromatografía de gases (FID) (Figura 1) permitió estimar la presencia de 56 constituyentes en el aceite esencial analizado, los cuales son consistentes con los reportados en la Tabla 4 que muestra el resultado del análisis CG/EM del aceite venezolano (Figura 2), en el mismo se identificaron 4 compuestos abundantes con alto valor agregado en las industrias farmacéutica, cosmetológica y de perfumes, tales como el 1,8-cineol (38%), nerolidol (29%), alloaroma-dendreno (14%) y α-terpineol (13%). El restante 6% está representado mayoritariamente por compuestos cuyas áreas de integración de picos, en fracciones expandiendo (Figura 2) el cro-matograma del aceite puro, resultaron menores de 0.05%. Los compuestos 47-49, 51, 52, 54, 56 y 57 (Tabla 4), se identificaron tentativamente como sesquiterpenos por sus espectros de masas con ion molecular m/e 204 y los picos característicos a 69, 91, 105, 161 y 189.
La herencia genética es la razón primaria, y la edad de las plantas conjuntamente con los factores ambientales un factor secundario, que influyen en las diferencias de composición de los aceites esenciales de una misma especie23. El habitat modifica el contenido de los aceites esenciales de Melaleuca halmaturorum y de Melaleuca quinquenervia14. En consecuencia, consideramos que las condiciones ecológicas tropicales donde se encuentran los árboles venezolanos, influyen en las propiedades fisicoquímicas (Tabla 1), en la actividad biológica (Tablas 2 y 3) y en la composición (Tabla 4) del aceite de sus hojas. Atendiendo al contenido de 1,8-cineol, el aceite esencial venezolano se semeja al aceite vietnamés15, pero difiere de los quimiotipos con altas concentraciones de metileugenol y de E-metilisoeugenol como compuestos principales7. En el aceite esencial de las hojas de Melaleuca leucadendron venezolano, se identificaron como novedosos (Tabla 4), canfeno, benzaldehido, mirceno, 3-careno, γ-terpineno, terpinoleno, benzoato de metilo, dehidrocarveol, ácido cinámico, ocimeno, 4-hidro-xi-2-metilacetofenona, isoeugenol, α-ferneseno, nerolidol, espatulenol y benzoato de bencilo.
Además, se identificaron tentativamente como no citados previamente para aceites de esta especie de otras regiones el 3,7-dimetil-l-3,7-octatrieno, 4-careno, 5-caranol, γ-terpineol, β-maalieno, isocariofileno, γ-gurjuneno, α-cariofileno, eremofileno, α y γ-muuroleno, β-elemeno, sativeno, ledeno, ledol, ocho sesquiterpenos, un sesquiterpenol y α-bisabonol.
1 |
α-pineno |
0,87 |
b,c |
15,25 |
2 |
canfeno |
Tr |
b,c, |
- |
3 |
benzaldehido |
0,24 |
b,c |
- |
4 |
β-pineno |
0,34 |
b,c |
15 |
5 |
mirceno |
0,06 |
b,c |
- |
6 |
1,8-cineol |
38,38 |
b,c |
15,25 |
7 |
3-careno |
Tr |
b,c |
- |
8 |
γ-terpineno |
0,15 |
b,c |
- |
9 |
terpinoleno |
0,05 |
b,c |
- |
10 |
benzoato de metilo |
0,05 |
b,c |
- |
11 |
3,7-dimetil- |
0,12 |
b |
- |
12 |
1,3,7-octatrieno |
Tr |
b |
- |
13 |
4-careno dehicarveol |
0,05 |
b,c |
- |
14 |
5-caranol |
Tr |
b |
- |
15 |
γ-terpineol |
0,39 |
b |
- |
16 |
α-terpineol |
12,58 |
b,c |
15,25 |
17 |
ácido cinámico |
Tr |
b,c |
- |
19 |
ocimeno |
Tr |
b,c |
- |
21 |
4-hidroxi-2-metilacetofenona |
Tr |
b,c |
- |
22 |
isoeugenol |
Tr |
b,c |
- |
23 |
germacreno |
Tr |
b,c |
7 |
24 |
caopaeno |
Tr |
b |
7 |
26 |
β-maalieno |
0,09 |
b |
- |
27 |
cariofileno |
0,76 |
b,c |
15 |
28 |
isocariofileno |
Tr |
b |
- |
29 |
g-gurjuneno |
Tr |
b |
- |
30 |
α-cariofileno |
Tr |
b |
15 |
31 |
eremofileno |
0,29 |
b |
- |
32 |
γ-selineno |
Tr |
b |
- |
33 |
γ-muuroleno |
Tr |
b |
- |
34 |
β-elemeno |
0,08 |
b |
- |
35 |
sativeno |
0,08 |
b |
- |
36 |
ledeno |
0,67 |
b |
- |
37 |
α-muuroleno |
Tr |
b |
- |
38 |
α-farneseno |
Tr |
b,c |
- |
39 |
γ-cadineno |
0,12 |
b |
7 |
40 |
cadineno |
0,16 |
b |
15 |
41 |
α-cubebeno |
Tr |
b |
7 |
42 |
<>aromaden-drenonerolidol | Tr |
b |
15 |
43 |
alloaroma- |
28,66 |
b,c |
- |
44 |
dendreno ledol |
14,38 |
b,c |
15 |
45 |
guaiol |
0,31 |
b |
- |
46 |
C15H26O |
Tr |
b,c |
15,25 |
50 |
α-bisabolol |
0,13 |
b |
- |
53 |
espatulenol |
Tr |
b |
- |
55 |
benzoato de bencilo |
Tr |
b,c |
- |
Número de picos desconocidos: 11 (19% con % total del Área = 0,5224)
a: Porcentaje de área de los picos.
Tr: Trazas para áreas < 0,05%
b: Cg-EM.
c: CO-CG
CONCLUSIONES
Los hallazgos en la caracterización del aceite esencial de las hojas de Melaleuca leitcadendron, con alto contenido de 1,8-cineol, nerolidol, alloaromadendreno y α-terpineol que se emplean como materias primas en las industrias farmacéuticas, cosmetológicas y de perfumes, así como también su actividad biológica sobre microorganismos, sugieren la conveniencia de propagar esta especie forestal con propósitos de desarrollo agroindustrial para el país.
AGRADECIMIENTO
Al Decanato de Investigación de la Universidad Nacional Experimental del Táchira y a la Universidad del Zulia por financiar el trabajo. Al Dr. Miguel Alonso de la Universidad de Los Andes por los bioensayos con coleópteros. A la Secretaria Neisa Villamizar por la transcripción de los manuscritos.
FIGURAS
|
|
|