
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
V CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES - SALTA 1989
Volumen XI - 1993 - pág 63 a 74.ESTEREOQUÍMICA DE LA INTEGRIFOLIDIONA Y ESTRUCTURA DE LA AFRICANONA, DOS CICLOPROPILCETONAS DE Lippia integrifolia. * Instituto de Química Orgánica, Facultad de Bioquímica, Química y Farmacia. Universidad Nacional de Tucumán. Ayacuho 491.4000 S.M. de Tucumán.
U.S. de Fenik *, G.H. Dartayet ** y C.A.N.Catalán *
** Departamento de Química Orgánica, Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. 1428 Buenos Aires.ABSTRACT
A revised structure for the ketone africanone isolated from Lippia integrifolia is propossed on the basis of chemical and spectroscopic evidence. The revised structure has a novel sesquiterpene skeleton which was named lipifoliane. In the bicyclic diketone integrifolidione the ten membered ring is joined cis to the cyclopropane.
La estructura 1 propuesta para una cetona tricíclica aislada por nosotros (1) de Lippia integrifolia (Griseb.) Hieron, se basó esencialmente en los datos de RMN protónica a 360 MHz. El nombre de africanona con que fue designada surgió de la analogía estructural con el alcohol sesquiterpénica africanol 2 aislado en 1974 de Lemnalia africana (2).
El espectro IR de la cetona tricíclica de L. integrifolia mostró bandas de diagnóstico a 3055, 1665 y 1595 cm-1 indicando la presencia de un grupo carbonilo α - β-insaturado. Dado que la vibración de tensión del doble enlace a 1590 cm-1 no es intensa se infiere además una disposición s-trans (3,4) del sistema conjugado.
El espectro de masa mostró un ion molecular intenso a m/z 218 (80%) conducente a la fórmula C15H22O que posee cinco insaturaciones de las cuales dos corresponden al sistema carbonílico α - β-insaturado y las tres restantes darían lugar a un esqueleto tricíclico. Los espectros de 1H-RMN a 360 MHz dé la cetona en CDC13 y C6D6 se muestran en la Fig. 1 donde la ausencia de señales para protones vinílicos indica que el doble enlace es tetrasustituído. Esto parecería estar en desacuerdo con la evidente señal a 3056 cm-1 en el IR, característica de la vibración de tensión de protones vinílicos. Sin embargo en dicha región absorben también ciclopropanos y cis-epóxidos. Estos dos grupos se pueden diferenciar ya que los primeros presentan una señal a 1020 cm1, que efectivamente estaba presente en el espectro, y los epóxidos a 1250 cm-1 (3,4). La presencia de un ciclopropano quedó confirmada por las señales típicas a 0.27 y 0.82 ppm en el espectro protónico en CDCl3 (Fig. 1). Con los datos anteriores pueden postularse entonces las subestructuras A y B.
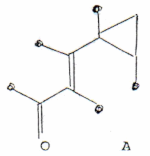
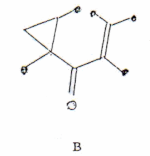
Una decisión entre A y B puede obtenerse por espectroscopia UV. Nuestro producto mostró 1max (EtOH) 257 nm (e 10.000) y 345 nm (e 57). El valor teórico calculado (5) por las reglas de Woodward para una cetona α - β-insaturada con doble enlace tetrasustituído es de 249 nm que no concuerda con el valor experimental de 257 nm. El desplazamiento batocrómico de 8 nm puede atribuirse a una extensión de la conjugación con el anillo ciclopropano que, como es conocido, posee ciertas características de doble enlace (6). Lo expuesto apoya la subestructura A a causa de que en B la conjugación es cruzada.
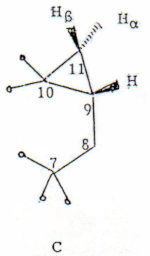
En el espectro protónico a 360 MHz en CDC13 (Fig. 1) se destacan cuatro señales de 3 hidrógenos c/u correspondientes a grupos metilos y las señales a δ 0.27 y δ 0.82 ppm de protones ciclopropílicos. Tres de los metilos son singletes y por lo tanto se encuentran sobre carbonos cuaternarios. La señal a 0.27 ppm es un doble doblete (dd) o que indica acoplamiento con dos protones. Por experimentos de doble resonancia (DR) y por las magnitudes de los acoplamientos se encontró que el dd a 0.27 ppm está acoplado con el dd a 0.82 y con el cuatro veces doblete a 1.07. Las dos primeras señales muestran una acoplamiento de 3.9 Hz, valor característico del acoplamiento geminal en protones ciclopropílicos (7). Por otra parte, el acoplamiento de las señales a 0.27 y 0.82 ppm con el dddd a 1.07 es de 4.1 y 7.8 Hz respectivamente. Dado que en ciclopropanos Jcis es mayor que Jtrans (7) los protones 11 α (dd a 0.27 ppm) y 11 β (dd a 0.82 ppm) deben estar trans y cis respectivamente de H-9 (dddd a 1.07 ppm). Este último hidrógeno está a su vez acoplado con los protones que aparecen a δ 1.12 (parcialmente oscurecido por la intensa señal del metilo doblete) y δ 1.83, ambos como dd con acoplamiento geminal de 13.5 Hz. Por lo tanto ambos corresponden al metileno de C-8 que esta unido a un C-7 de naturaleza cuaternaria.
Estos datos conducen a la subestructura C.
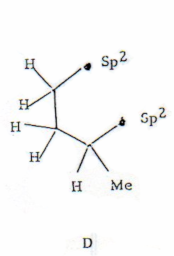
En la zona de campos bajos se observan dos señales a 2.45 y 2.33 ppm, ambas como ddd formando un sistema AB que evidentemente corresponden a un metileno como lo demuestra la constante de acoplamiento geminal de 17.7 Hz cuya magnitud indica además que se encuentran contiguos a un carbono sp
2. Los protones de este metileno están acoplados a los hidrógenos ubicados a δ 1.96 ppm que, por aparecer como cuádruple dobletes, están unidos a otro carbono que posee un solo hidrógeno. Este último protón aparece a δ 2.18 ppm y debe ser vecino a un carbono sp2 y a un metilo pues aparece como ddp con el J del cuarteto igual a 6.9 Hz, idéntico al del metilo doblete centrado a δ 1.11 ppm. Se puede entonces ensamblar con estos datos la subestructura D. Como ya tenemos un sistema carbonílico α, β-insaturado con el doble enlace tetrasustituído (subestructuras A y B), el ensamblaje con las subestructuras C y D conduce a las subestructuras E, F y G únicamente. 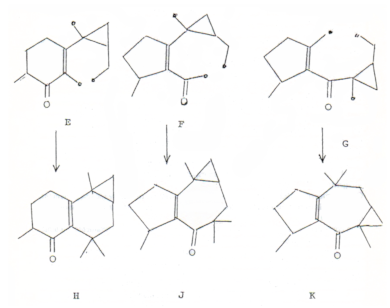
Tanto E como F y G tienen asignados 11 carbonos y dado que faltan ubicar los tres metilos singletes, resta un carbono que debe ser cuaternario para satisfacer la fórmula.
Es obvio entonces que los sustituyentes sobre este carbono cuaternario deben ser dos metilos y el restante metilo sustituye el ciclopropano derivándose así las fórmulas H, J y K. La estructura K puede ser eliminada dado que los valores de δ para los patrones del ciclopropano no concuerdan con los que deberíamos esperar (0.68 y 1.17 ppm). Además dicha estructura presenta conjugación cruzada que ya había sido descartada al considerar el espectro UV. Por su parte, el esqueleto carbonado de J tiene antecedentes conocidos ya que es idéntico al encontrado en los sesquiterpenos 3, 4 y 5 aislados de Senecio oxyriifolius (8) y al alcohol terciario africanol 2 aislado de Lemnalia africana (2).
Con respecto a la estructura H no hemos encontrado antecedentes de un esqueleto de ese tipo, siendo lo más parecido un diterpeno que tiene la estructura 6 (12) que fue aislado de Gnaphalium undulatun (Compositae).
La comparación en los datos de RMN para los protones de la zona del ciclopropano de la cetona tricíclica aislada de L. integrifolia (1) con los reportados para africanos 2 (2), los sesquiterpenos 3-5 (8) y el diterpeno 5, nos indujo a inclinamos por la estructura 1 que fue la propuesta en el trabajo anterior (1).
Adicionalmente, el hecho de que el esqueleto carbonado de 1 había sido encontrado en otros vegetales (8) y a que T. Matsumoto y col. (9, 10) en un trabajo de síntesis biomimética a partir de 9, 10-epóxido de humuleno habían obtenido compuestos similares a 1 y a la dicetona 8 que también se encuentra presente en el aceite esencial de L. integrifolia (11), reafirmaban nuestra elección.
En la Tabla I se encuentran resumidos los datos de RMN protónica de la cetona tricíclica de L. integrifolia.
Aunque todos los datos espectroscópicos discutidos previamente estaban de acuerdo con la estructura 1, restaba analizar en detalle las fragmentaciones observadas en el espectro de masa. Aunque es sabido que los EM de mono- y sesquiterpenoides son en general difíciles de interpretar inequivocadamente a causa de los extensivos reordenamientos que ocurren por impacto electrónico, algunos de los iones más significativos observados son muy difíciles de racionalizar con la estructura 1, en particular los iones a m/z 176 correspondiente a la eliminación del fragmento C3H6 a partir del ion molecular y el pico base a m/z 133. En la Tabla 2 se dan los datos resumidos del espectro de masa de la cetona tricíclica de L. integrifolia.
Como se muestra en la Fig. 2, los resultados del EM pueden ser racionalizados elegantemente adoptando la estructura 7 para la cetona tricíclica a la que previamente asignáramos (1) la estructura 1.
Para confirmar que la estructura de nuestra cetona tricíclina era verdaderamente 7 intentamos sintetizarla empleando como material de partida la biciclohumulendiona 8, que es también un componente del aceite esencial de Lippia integrifolia (11) que bautizamos con el nombre de integrifolidiona. Debemos notar aquí que aunque la estructura gruesa de 8 está firmemente establecida, la estereoquímica alrededor del ciclopropano fue asignada solo por analogía con la (+) biciclohumulenono 9 aislada de la hepática Plagiochila acanthopylla (13,14). Era evidente que si el sistema bicíclico de 8 presentaba fusión trans alrededor del ciclopropano sería imposible obtener un producto de condensación intramolecular semejante a 7 a causa de las restricciones estéricas y geométicas impuestas al sistema como puede verse claramente en un modelo molecular Dreiding. En consecuencia este es un método que sirve para establecer la estereoquímica de 8. Así, por tratamiento de 8 con KOH en metanol a reflujo obtuvimos un producto cuyo espectros IR y de masa resultaron prácticamente idénticos al del producto natural 7. Por otra parte, el espectro protónico a 100 MHz del producto sintético 10 mostró el desdoblamiento de algunas señales como cabía esperar dado que el medio básico empleado para producir la condensación produjo también la racemización del metilo sobre C-4. El espectro protónico indicó que el producto sintético era una mezcla 1:1 de epímeros de C-4, ambos con el Me- 15 pseudoecuatorial que es la conformación más estable.
En el producto natural 7 el Carbono 3 se encuentra por debajo y el Carbono 4 por encima del plano determinado por el sistema a, (5-insaturado mientras que en el otro epímero la situación es exactamente a la inversa. En la tabla 3 se muestran comparativamente algunas señales seleccionadas del 1H-RMN del producto sintético 10 con respecto del producto natural 7.
En síntesis, todos los resultados obtenidos permiten proponer la estructura revisada 7 para la cetona tricíclica aislada de L. integrifolia (1) a la que por poseer un esqueleto diferente al originalmente postulado (1) debe obviamente retirársele el nombre de africanona. Surgerimos aquí el nombre de lipifoliona para 7 y de lipifoliano para el nuevo esqueleto sesquiterpénico 11.
Actualmente la evidencia química presentada indica una estereoquímica cis para la fusión del sistema bicíclico de 8. Se encuentran en progreso estudios de NOE, Rayos-X y Dicroismo Circular para establecerla configuración absoluta de 7 y 8.
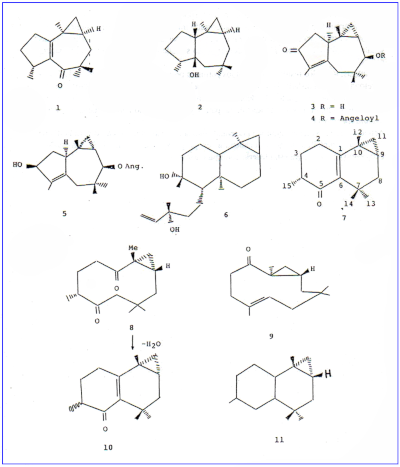
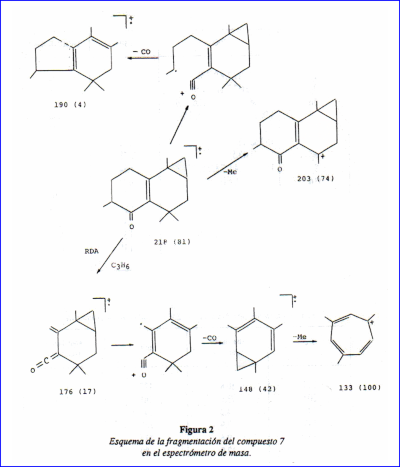
TABLA I - Datos espectrales de 1H-RMN de la cetona tricíclica aislada de L. integrifolia (compuesto 7).
360 MHz, ChCl3 como estándar interno)*
PROTON
CDCl3
C6D6
D/C6D6 + Eu(fod)3
2α
2.33 ddd (17.7, 4.9, 3.6)
1.93
0.12
2β
2.45 ddd (17.7, 11.6, 4.5)
2.02
0.16
3α
1.50 dddd (12.7, 4.9, 11.6, 11.6)
1.22
0.21
3β
1.96 dddd(12.7, 3.6, 4.5, 5.0)
1.54
0.14
4β
2.18 ddq (11.6, 5.0, 6.9)
1.98
0.52
8α
1.12 dd (13.5, 5.5)
1.11
0.12
8β
1.83 dd (13.5, 7.7)
1.78
0.08
9β
1.07 dddd (4.1, 7.8, 5.5, 7.7)
0.84
0.04
11α
0.27 dd (3.9, 4.1)
0.10
0.08
11β
0.83 dd (3.9, 7.8)
0.58
0.04
12
1.17 s
0.92
0.03
13
1.18 s
1.46
0.30
14
1.18 s
1.37
0.18
15
1.11 d (6.9)
1.15
0.28
* constantes de acoplamiento en Herzios entre paréntesis.
TABLA II - Fragmentaciones observadas en el EM por impacto electrónico de 7
m / z
ABUNDANCIA RELATIVA %
m / z
ABUNDANCIA RELATIVA %
218
80.8
175
14.3
203
73.9
161
26.3
190
4.2
148
41.9
189
3.9
147
12.2
177
9.6
133
100
176
17.0
89
24.4
TABLA III - Comparación de señales seleccionadas de los espectros protónicos (100 MH, CDCl3) de 7 y 10
PROTÓN
7
10
11α
0.27 dd
0.27 dd
0.30 dd
11β
0.83 dd
0.83 dd
12
1.17 s
1.17 s
13
1.18 s
1.18 s
14
1.18 s
1.18 s
1.20 s
15
1.11 d
1.11 d
1.13 d
REFERENCIAS Y NOTAS
- G. H. Dartayet, C.A.N. Catalán, J.A. Retamar y E. Gros (1984) Phytochemistry 23,688
- B. Tursch, J. C. Braekmann, D. Daloze, P. Fritz, A. Kelecom, R. Karlsson y D. Losman (1974), Tetrahedron Lett. 747.
- D.J. Pasto y C.R. Johnson, (1974) Determinación de Estructuras Orgánicas, Editorial Reverte S.A.
- L. J. Bellamy (1959) The Infra-red Spectra of Complex Molecules. p. 132, J. Wiley & Sons, Inc.
- A. I. Scott(1964 Interpretation of the Ultraviolet Spectraof Natural Products. MacMillan, New York.
- A. D. Walsh (1949) Trans. Faraday Soc. 45,179.
- I. Fleming y D.H. Williams (1974) Métodos Espectroscópicos en Química Orgánica, p. 119. Ediciones Urmo S.A.
- F. Bohlmann y C. Zdero (1978) Phytochemistry 17, 1669.
- H. Shirayama, E. Osawa y T. Matsumoto (1980) J. Am. Chem. Soc. 102,3201.
- H. Shirayama, K. Hayano, Y. Kanemoto, S. Misumi, T. Ohtsuka, N. Hashiba, A. Furasaki, S. Murta, R.Noyori y T. Matsumoto (1980), Tetrahedron Lett. 4835.
- C. A. N. Catalán, D.I. Jglesias, J. A. Retamar, J. B. Iturraspe, G. H. Dartayet y E. G. Gros (1983) Phytochemistry 22, 1507.
- F. Bohlmann y J. Zeische (1980) Phytochemistry 19,71.
- A. Matsuo, H. Nozaki, M. Nakayama, Y. Kushi y S. Hayashi (1979) J. C. S.Chem Commun 175.
- La forma enantiomérica de 10 fue aislada de Acritopapus prunifolius. VerF. Bohlmann, C. Zdero, R.M. King y H. Robinson (1982). Phytochemistry 21,147.
FIGURAS
Figura 1 a. - 1H-RMN de la "africanona" (360 MHz, CDCl3)
Figura 1 b. - 1H-RMN de la "africanona" (360 MHz, C6D6)
|
|
|