
TRABAJOS CIENTIFICOS
Plantas medicinales, aromáticas y tintóreas.
 |
|
||
Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos
V CONGRESO NACIONAL DE RECURSOS NATURALES AROMÁTICOS Y MEDICINALES - SALTA 1989
Volumen XI - 1993 - pág 36 a 43.SÍNTESIS DE ESTERES TERPENICOS A PARTIR DE ALCOHOLES TERCIARIOS * Departamento de Química, Facultad de Ciencias, Universidad de Chile, Casilla de Correo 653, Santiago, Chile.
G. Portilla y C. Ferrari *
RESUMEN
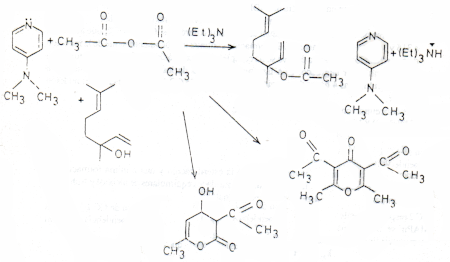
Muchos aceites esenciales tienen aromas característicos y muy apetecidos debido a la presencia de determinados esteres terpénicos. Algunos de estos esteres pueden ser fácilmente sintetizados a partir del alcohol respectivo, anhídrido o cloruro acético y piridina. Sin embargo, los alcoholes terciarios son resistentes a la esterificación con estos reactivos, por lo que se emplean 4-dialguilaminopiridinas como catalizadores (1).
En este trabajo se ha logrado sintetizar linalilacetato, a partir del alcohol respectivo linalol y anhídrido acético, en presencia de 4-Dimetilaminopiridina y trietilamina. Se obtienen rendimientos de 90 - 95% bajo condiciones de temperatura y tiempo controladas.
En el curso de la reacción se forman dos compuestos coloreados que absorben a 315 y 345 nm. Su formación continúa independientemente de la reacción de esterificación, y cuando ésta ya se ha completado, la coloración continúa aumentando hasta alcanzar un color negruzco.
Se estudió la cinética de formación del éster y de los compuestos coloreados; se obtuvieron los siguientes valores:
k ψ acetilación = 5,6 x 10-4 seg-1
k aparente CC1 = 3,2 x 10-5 seg-1
k aparente CC2 = 5,8 x lO-6 seg-1Estos compuestos contaminantes quedan completamente retenidos en columna de sílica gel 60-H y se logra obtener el éster libre de impurezas.
CONCLUSIONESEn este trabajo se ha logrado sintetizar linalil acetato a partir del alcohol respectivo, linalol, y anhídrido acético en presencia de 4-DMAPir y TEA. Se obtienen rendimientos entre 90 y 95% bajo condiciones de temperatura (25a) y tiempo (4 horas) controladas.
En el curso de esta reacción se forman compuestos coloreados, CC1 y CC2, que absorben a 315 y 345 nm respectivamente. Su formación continúa independientemente de la reacción de esterificación, y cuando ésta ya se ha completado la coloración continúa aumentos hasta alcanzar un color negruzco. Con las concentraciones de los reactivos que se indican acontinuación, a las 4 horas de reacción se forma 10% de CC1 y 2,5% de CC2 en relación al éster.
Las concentraciones de los reactivos fueron:
[LOH] = 0,8 M
[Anh. Ac.] = 2,4 M
[4-DMAPir] = 0,8 M
[TEA] = 4,57 MA fin de obtener el mayor rendimiento en la esterificación y una mínima formación de compuestos coloreados, convendría utilizar cantidades equimolares de alcohol y Anhídrido acético, agregando éste último en forma gradual.
Se comparan las velocidades de formación de éster con la de formación de CC1 y CC2 al modificar la concentración de 4-DMAPir entre 0,024 y 0,12 M. La dependencia es lineal y obtiene:
kψ acetilación = 5,6 x 10-4 seg-1
Kap CC1 = 3,2 x lO-5 seg-1
kap. CC2 = 5,8 x 10-6 seg-1Esto indica que el éster se forma 17 y 97 veces más rápido que CC1 y CC2 respectivamente. En estas condiciones de reacción se pudo comprobar que 4-DMAPir se transforma completamente en el verdadero reactivo acetilante N-acetil-4-dimetilaminopiridinio. Se detectó por espectroscopia IR la formación de una especie, probablemente acetil-trietilamonio, entre trietilamina y anhídrido acético. Este intermediario, que se detecta desde 6 horas de reacción, puede participar en reacciones de esterificación del alcohol primario geraniol pero no se encontraron evidencias de que lo haga en la esterificación de LOH.
La esterificación del linalol resulta muy lenta y con un bajo rendimiento (70 horas, 3%) en acetonitrilocomo solvente y sin TEA. Adiciones crecientes de TEA aceleran y aumentan la cuantitividad de la reacción, lo cual se puede atribuir a su participación como base. Si bien se exploró cinéticamente el mecanismo de la reacción, será necesario ampliar estos estudios para explicar cabalmente el papel que cumple TEA en la reacción, haciendo un análisis detallado a bajas concentraciones de este reactivo. Esto podría permitir determinar cuál es la etapa más lenta de la reacción.
Purificación del éster:
El éster se separó y purificó del resto de reactivos y de compuestos coloreados por medio de:
Agregado de hexano y lavado de la fase obtenida con solución saturante de NaHCO3.
Se observó hidrólisis del éster en esta etapa por lo que fue necesario efectuarla rápidamente y a 3-4 °C.
Separación de productos por columna flash de sílica gel 60-H que se eluye sucesivamente con hexano, hexano: acetato de etilo 7:1, CHCl3 y acetona. CC1 eluye de la columna con acetona y CC2 con CHC13.
El diseño e interpretación de los experimentos cinéticos se basó en el modelo que se presenta en el esquema 2.
Esquema 2
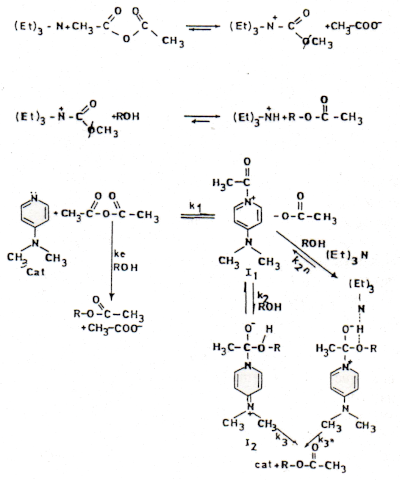
TABLA - ACETILACIÓN DE ALCOHOLES
ROH
CAT.
T (°C)
TIEMPO (HORA)
% ACETILACIÓN
NOH
Pir
20 - 22
1
77
LOH
Pir
20 - 22
25
N.H.R.
LOH
Pir
97
25
16
LOH
4-AminoPir
25
50
N.H.R.
GOH
4-DMAPir
25
0,1
100
LOH
4-DMAPir
25
4
90
AGRADECIMIENTOS
Se agradece el financiamiento de este trabajo a la Dirección de Investigación Científica y Tecnológica de la Universidad de Chile (Proyecto Q-2818).
BIBLIOGRAFÍA
1. Hofle, G., Steglich, W. y Vorbruggen, H. Angew. Chem. Int. Ed. 17:569 (1978).
FIGURAS Y TABLAS
a) Espectro parcial intermediario 4-Dimetilaminopiridinio
b) Efecto de concentración de Anh. Ac. sobre absorción de intermediario.
(A) Curva de acetilación de LOH con 4-DMAPir como catalizador.
Formación de compuestos coloreados en función del tiempo CC1 y CC2.
[LOH] = 0;8 M; [Anh.Ac.] = 2;4 M [4-DMAPir] = 0,8 M.
[TEA] = 4,57 M; T° = 25.
Curva de progreso de la esterificación de LOH.
[LOH] = 0,8 M; [Anh.Ac.] = 2;4 M [4-DMAPir] = 0,05 M.
Solvente acetonitrilo
Zona 1 = No contiene TEA
Zona 2 = TEA = 0,64 M (0,8 excesos TEA/LOH)
Zona 3 = TEA = 3,6 M (4,5 excesos TEA/LOH).
Velocidad de formación de LAc, CC1 y CC2 en función de la concentración de 4-DMAPir.
[Anh. Ac.] = 2,4 M; [LOH] = 0,8 M; [TEA] = 4,57 M.
|
|
|